

Moku:Pro 的锁相放大器 (LIA) 为受激拉曼散射 (SRS) 显微镜实验中的自外差信号检测提供了一种直观、精确且稳健的解决方案。高质量的 LIA 是 SRS 显微镜实验中具有调制传输检测方案的关键硬件组件。在此更新的案例研究中,我们提供了有关双 LIA 应用程序的更多详细信息和描述。
展示全部 
锁相放大器用于生物样品双通道和多仪器模式SRS显微技术的研究
本文由昊量光电翻译整理,文章内容由华盛顿大学化学系的 Brian Wong 和 Dan Fu 提供,并由Liquid公司提供原文。
一.简介
拉曼散射光谱为生物分子的特异性检测和分析提供了化学键的固有振动指纹。那么什么是受激拉曼散射显微镜?受激拉曼散射(SRS)显微技术是一种相对较新的显微技术,是一种相干拉曼散射过程,允许使用光谱和空间信息进行化学成像[18],由于相干受激发射过程[1]能产生约103-105倍的增强拉曼信号,可以实现高达视频速率(约25帧/s)[2]的高速成像。SRS显微镜继承了自发拉曼光谱的优点, 是一种能够快速开发、label-free的成像技术,同时具有高灵敏度和化学特异性[3-6], 在许多生物医学研究的分支显示出应用潜力,包括细胞生物学、脂质代谢、微生物学、肿瘤检测、蛋白质错误折叠和制药[7-11]。特别的是,SRS在对新鲜手术组织和术中诊断的快速组织病理学方面表现出色,与传统的H&E染色几乎完全一致[12,13]。此外,SRS能够根据每个物种的光谱信息,对多种组分的混合物进行定量化学分析[6,7,14]。
尽管在之前的研究[17]中已经研究了痛风中MSU的自发拉曼光谱,但微弱的信号强度阻碍了其用于快速组织学的应用。因此,复旦大学附属华山医院华英汇教授 和复旦大学物理学系季敏标教授团队将受激拉曼散射显微技术用于人体痛风组织病理成像[15]。研究人员应用SRS和二次谐波(SHG)显微镜同时表征了晶型和非晶型MSU。在普通光镜下,MSU晶体呈典型的针状。这些晶体在拉曼峰630 cm-1的SRS上很容易成像,当SRS频率稍微偏离振动共振时,表现出了高化学特异性的非共振行为,SRS信号消失。已知SHG对非中心对称结构敏感,包括MSU晶体和[17]组织中的胶原纤维。然而,由于拉曼极化率张量和二阶光学磁化率对晶体对称性[16]的依赖,研究者们发现线偏振光光束在晶体取向上倾向于产生SRS和SHG的强各向异性信号。因此,研究者们对泵浦光束和斯托克斯光束都应用了圆偏振,以消除MSU晶体和胶原纤维的定向效应。
Moku:Pro 的锁相放大器 (LIA) 为受激拉曼散射 (SRS) 显微镜实验中的自外差信号检测提供了一种直观、精确且稳健的解决方案。高质量的 LIA 是 SRS 显微镜实验中具有调制传输检测方案的关键硬件组件。在此更新的案例研究中,我们提供了有关双 LIA 应用程序的更多详细信息和描述。
由于SRS 是一种相干拉曼散射过程,允许使用光谱和空间信息进行化学成像[18]。它使用两个同步脉冲激光器,即泵浦和斯托克斯(图 1)相干地激发分子的振动。当入射到样品上的两束激光的频率差与目标分子的振动频率相匹配时,就会发生 SRS 过程。振动激发的结果是泵浦光束将失去光子,而斯托克斯光束将获得光子。当检测到泵浦光束的损失时,这称为受激拉曼损失 (SRL) 检测。强度损失 ΔIₚ/Iₚ 通常约为 10 -7 -10 -4,远小于典型的激光强度波动。为了克服这一挑战,需要一种高频调制和相敏检测方案来从嘈杂的背景中提取 SRS 信号[19]。在 SRL 检测方案中,斯托克斯光束以固定频率调制,由此产生的调制传输到泵浦光束由 LIA 检测。
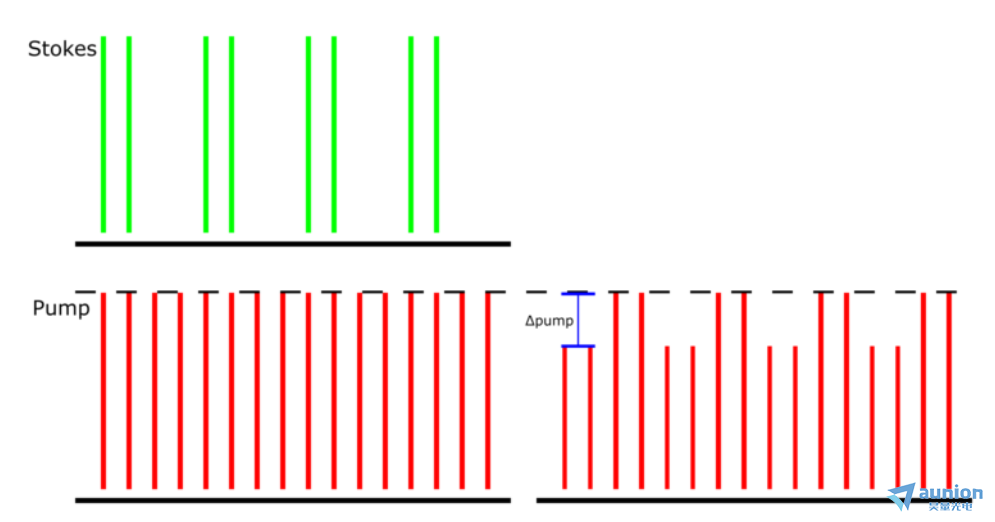
图 1:受激拉曼损耗检测方案。检测到由于 SRS 引起的 Stokes 到泵浦光束的调幅传输。演示的泵浦光束具有 80 MHz 的重复率,Stokes 光束具有相同的 80 MHz 重复率,但也以 20 MHz 进行调制。Δpump 是 LIA 在此检测方案中提取的内容
二.实验装置
使用的激光系统能够输出两个 80 MHz 的激光脉冲序列:斯托克斯光束在 1030 nm,泵浦光束在 790 nm。激光输出也用于同步调制:80 MHz 参考被发送到分频器以生成 20 MHz TTL 输出。这些 20 MHz 输出被使用两次:一次作为电光调制器调制斯托克斯光束的驱动频率,另一次作为外部锁相环的 LIA 输入通道 2(B 中)的参考。泵浦光束由硅光电二极管检测,然后被发送到 LIA 的输入通道 1(In A)。来自输出通道 1(Out A)的信号被发送到数据采集卡以进行图像采集。来自输出通道 2 (Out B) 的信号被最小化(通过调整相移)。
2.1 单通道锁相放大器配置

图 2:典型的锁定放大器配置设置
图 2 演示了用于 SRS 显微镜实验的 LIA 的初始设置。在初始设置时,必须重新获取锁相环。输入均配置为 AC:50 欧姆。通过调整相位度数优化相移 (Df),直到 Out A 最大化(正值)并且 Out B 最小化(接近零)。探针A显示对应于 DMSO 最高信号峰 (2913 cm-1 ) 的 SRS 信号,并最大化输出 A 的 103.3 mV。探针B表示正交输出,最小化为零。一旦 LIA 针对校准溶剂进行了优化,样品就可以进行成像了。
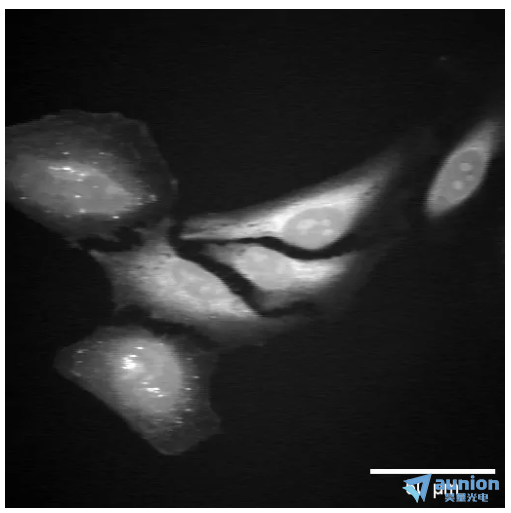
图 3:2930 cm -1拉曼跃迁处的 SRS HeLa 细胞图像
图 3 是使用 Moku:Pro 锁相放大器拍摄的 HeLa 细胞图像。显示的图像是从 SRS 图像生成的,拉曼位移为 2930cm-1,对应于蛋白质峰。低通滤波器设置为 40 kHz,对应于 约4µs 的时间常数。可以根据SRS信号大小增加或减少增益。
2.2 双通道成像
Moku:Pro 的 LIA 也适用于实时双色 SRS 成像。这是通过在 SRS 成像中应用正交调制并检测LIA的X和Y输出来执行的。在这种情况下,斯托克斯调制有两个部分:一个 20 MHz 脉冲序列生成SRS信号,另一个 20 MHz 脉冲序列具有90°相移,生成另一个针对不同拉曼波段的SRS信号[3]。由于90°相移,两个通道(Out A和Out B)彼此正交,可以同时获取两个SRS图像而不会受到干扰。

图 4:使用正交调制和输出在两个不同的拉曼跃迁下同时获得鼠脑样本的双通道 SRS 图像
图 4 是利用双通道X&Y输出同时在2930 cm -1和 2850 cm -1处生成两个 SRS 图像的代表性图像。
2.3 多仪器模式应用
在大多数 SRS 显微镜实验中,由于激光器总带宽的限制,光谱范围被限制在大约 300 cm -1左右。绕过这一技术障碍的一种方法是使用可调谐激光器扫描波长。然而,波长调谐速度很慢,而且对于时间敏感的实验(如活细胞成像)来说往往不够。应对这一挑战的另一种解决方案是引入第三束激光束来扫描不同的拉曼过渡区域。这种能力对于两个光谱区域的同时成像特别有吸引力:一个在指纹区域(例如 约1600 cm-1用于酰胺振动)和一个在CH区域(例如 约2900 cm -1蛋白质)。在 SRL 成像方法中,实验装置由一个斯托克斯光束和两个不同波长的泵浦光束组成。此设置的常用检测方法需要单独的检测器和单独的 LIA。然而,Moku:Pro 的多仪器模式允许部署多个LIA,因此可以在不需要任何额外硬件妥协的情况下实施第二个LIA。
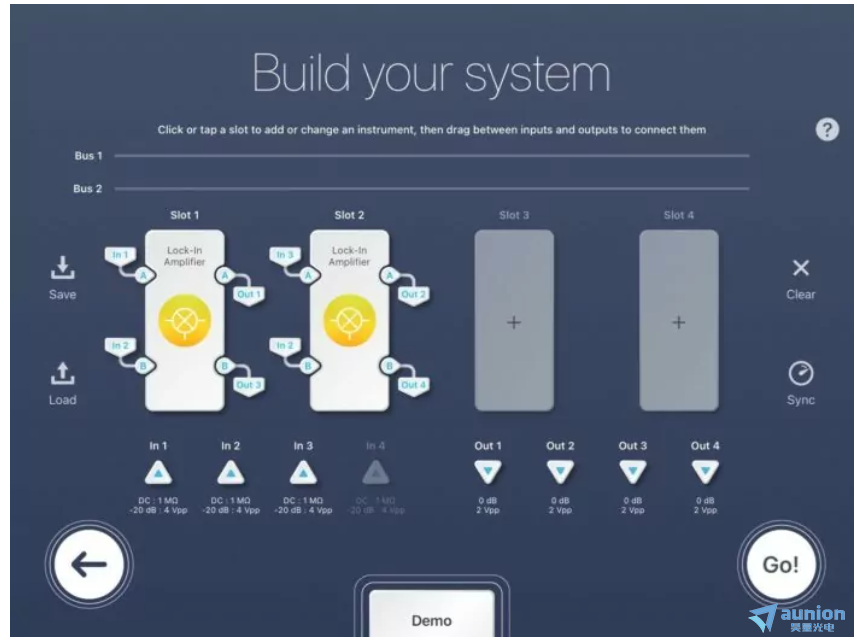
图 5:Moku:Pro 多仪器锁相放大器配置
图 5 演示了LIA 的多仪器模式设置,用于同步 SRS 显微镜实验。对于Slot 1,In 1是第一个光电二极管的检测信号,In 2是参考信号,Out 1是发送到数据采集卡的信号,Out 3被丢弃。对于 Slot 2,In 3 是第二个光电二极管的检测信号,In 2 再次作为参考,Out 2 是发送到数据采集卡的信号,Out 4 被丢弃。此配置仅使用 4 个 Moku 插槽中的 2 个。插槽 3 和 4 未分配,因此可用于进一步的 LIA 或任何其他 Moku 仪器。输入全部配置为 AC:50 欧姆。每个 LIA 插槽(1 和 2)都遵循与单通道 LIA 配置相同的设置。
在三个激光器的情况下,Moku:Pro 的多仪器模式可以配置两个锁定放大器,将系统简化为一个设备,而不会有任何妥协。这使得研究人员可以同时拍摄两张波数差较大的 SRS 图像,利用一个 Moku:Pro 来处理两个光电二极管检测器信号。
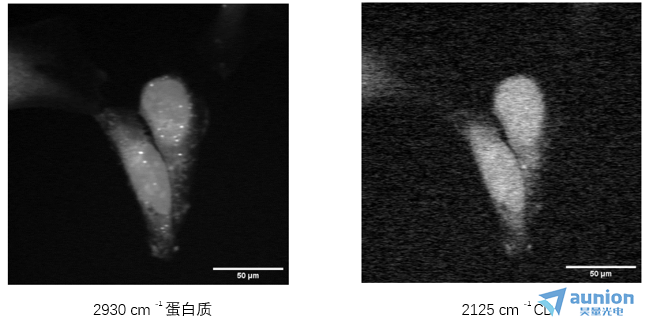
图 6:HeLa 细胞 SRS 图像使用多仪器设置在间隔较远的拉曼跃迁处拍摄
图 6 是利用一个Moku:Pro处理两个光电二极管检测器信号同时拍摄两个大波数差的 SRS 图像的代表性图像。
三.结论
Moku:Pro 的 LIA 为大量 SRS 显微镜实验提供了出色的解决方案。在本文档中,讨论了典型的单通道 SRS 成像、双通道成像和多仪器成像。用户界面允许对提取低强度 SRS 信号进行直观和强大的控制。重要的是 Moku:Pro 的多仪器工具功能允许在多仪器同用的紧凑型系统上进行复杂的成像实验。

图 7:Moku:Pro 在多乐器模式下的使用图像。In 1 和 In 3 分别是插槽 1 和插槽 2 中 LIA 的信号输入。2 中是两个 LIA 插槽的参考。在所示的配置中,Out 1 和 Out 3 是记录的信号,Out 2 和 Out 4 是插槽 1 和 2 的转储信号
参考文献:
1.Freudiger CW, Min W, Saar BG, Lu S, Holtom GR, He C. et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 2008;322:1857-61
2.Saar BG, Freudiger CW, Reichman J, Stanley CM, Holtom GR, Xie XS. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 2010;330:1368-70
3.Ji M, Lewis S, Camelo-Piragua S, Ramkissoon SH, Snuderl M, Venneti S. et al. Detection of human brain tumor infiltration with quantitative stimulated Raman scattering microscopy. Sci Transl Med. 2015;7:309ra163
4.Ji M, Arbel M, Zhang L, Freudiger CW, Hou SS, Lin D. et al. Label-free imaging of amyloid plaques in Alzheimer''s disease with stimulated Raman scattering microscopy. Sci Adv. 2018;4:eaat7715
5.Cheng JX, Xie XS. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 2015;350:aaa8870
6.Ao JP, Feng YQ, Wu SM, Wang T, Ling JW, Zhang LW. et al. Rapid, 3D Chemical Profiling of Individual Atmospheric Aerosols with Stimulated Raman Scattering Microscopy. Small Methods. 2020;4:1900600
7.Hu F, Shi L, Min W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nat Methods. 2019;16:830-42
8.Fu D, Zhou J, Zhu WS, Manley PW, Wang YK, Hood T. et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nat Chem. 2014;6:614-22
9.Shen Y, Zhao Z, Zhang L, Shi L, Shahriar S, Chan RB. et al. Metabolic activity induces membrane phase separation in endoplasmic reticulum. Proc Natl Acad Sci U S A. 2017;114:13394-9
10.Bae K, Zheng W, Ma Y, Huang Z. Real-time monitoring of pharmacokinetics of antibiotics in biofilms with Raman-tagged hyperspectral stimulated Raman scattering microscopy. Theranostics. 2019;9:1348-57
11.Shin KS, Laohajaratsang M, Men S, Figueroa B, Dintzis SM, Fu D. Quantitative chemical imaging of breast calcifications in association with neoplastic processes. Theranostics. 2020;10:5865-78
12.Ji M, Orringer DA, Freudiger CW, Ramkissoon S, Liu X, Lau D. et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Sci Transl Med. 2013;5:201ra119
13.Orringer DA, Pandian B, Niknafs YS, Hollon TC, Boyle J, Lewis S. et al. Rapid intraoperative histology of unprocessed surgical specimens via fibre-laser-based stimulated Raman scattering microscopy. Nat Biomed Eng. 2017;1:0027
14.He R, Liu Z, Xu Y, Huang W, Ma H, Ji M. Stimulated Raman scattering microscopy and spectroscopy with a rapid scanning optical delay line. Opt Lett. 2017;42:659-62
15.Li B, Singer NG, Yeni YN, Haggins DG, Barnboym E, Oravec D. et al. A point-of-care Raman spectroscopy-based device for the diagnosis of gout and peudogout: comparison with the clinical standard microscopy. Arthritis Rheum. 2016;68:1751-7
16.Zhang B, Xu H, Chen J, Zhu X, Xue Y, Yang Y, Ao J, Hua Y, Ji M. Highly specific and label-free histological identification of microcrystals in fresh human gout tissues with stimulated Raman scattering. Theranostics 2021; 11(7):3074-3088
17.Streets AM, Li A, Chen T, Huang Y. Imaging without fluorescence: nonlinear optical microscopy for quantitative cellular imaging. Anal Chem. 2014;86:8506-13
18.Freudiger, W.; Min, W.; Saar, B. G.; Lu, S.; Holtom, G. R.; He, C.; Tsai, J. C.; Kang, J. X.; Xie, X. S., Label-Free Biomedical Imaging with High Sensitivity by Stimulated Raman Scattering Microscopy. Science 2008, 322 (5909), 1857-1861.
19.Hill, H.; Fu, D., Cellular Imaging Using Stimulated Raman Scattering Microscopy. Anal. Chem. 2019, 91 (15), 9333-9342.
20.Figueroa, ; Hu, R.; Rayner, S. G.; Zheng, Y.; Fu, D., Real-Time Microscale Temperature Imaging by Stimulated Raman Scattering. The Journal of Physical Chemistry Letters 2020, 11 (17), 7083-7089.
更多详情请联系昊量光电/欢迎直接联系昊量光电
关于昊量光电:
上海昊量光电设备有限公司是光电产品专业代理商,产品包括各类激光器、光电调制器、光学测量设备、光学元件等,涉及应用涵盖了材料加工、光通讯、生物医疗、科学研究、国防、量子光学、生物显微、物联传感、激光制造等;可为客户提供完整的设备安装,培训,硬件开发,软件开发,系统集成等服务。
您可以通过我们昊量光电的官方网站www.auniontech.com了解更多的产品信息,或直接来电咨询4006-888-532。